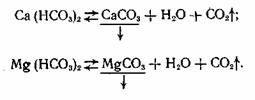
По минерализации и химическому составу природные воды характеризуются большим разнообразием. Степень их пригодности для тех или иных хозяйственных целей различная. Они не всегда удовлетворяют предъявляемым требованиям, в некоторых случаях их используют только после проведения соответствующей "водоподготовки". В связи с этим возникает проблема нормирования воды, которая, как известно, своими корнями уходит в далекое прошлое, но наибольшего прогресса достигла в последние десятилетия, когда вопросами нормирования стали заниматься многие научные и производственные учреждения.
При установлении норм хозяйственно-питьевых вод принимается во внимание минерализация (сухой остаток), содержание макро- и микрокомпонентов, физические свойства воды и ее санитарное состояние. К питьевой воде предъявляются следующие требования:
1) она должна быть прозрачной, бесцветной, освежающего вкуса и без запаха;
2) присутствие веществ, растворенных обычно в природной воде, не должно превышать некоторых пределов;
3) содержание вредных для здоровья человека веществ (меди, свинца, мышьяка и пр.) не должно превышать установленных для этих компонентов значений;
4) вода должна быть свободной от болезнетворных микроорганизмов.
Основным средством для оценки качества вод является химический и бактериологический анализ. Нормы питьевых вод устанавливаются авторитетными гигиенистами, конгрессами и различными учреждениями. Однако единых норм, отвечающих оптимальным физиологическим свойствам воды, до настоящего времени не выработано. Нормы качества воды, применяемой для централизованного водоснабжения, определяются ГОСТом. Этот стандарт не распространяется на воду, забираемую в порядке индивидуального нецентрализованного пользования непосредственно из местных источников, без разводящей сети труб.
Основное требование к физическим свойствам воды - отсутствие неприятного запаха и вкуса. Отрицательным свойством воды является наличие у нее цвета, появляющегося обычно вследствие примеси гумусовых веществ. Для городского водоснабжения воду с цветностью выше 30° (по платиново-кобальтовой шкале) очищают введением в нее небольших количеств сернокислого алюминия и извести. Однако в северных районах пьют воду и при значительно большей цветности, хотя вода имеет неприятный болотный привкус.
Вкусовые качества воды определяются прежде всего количеством и качеством растворенных в ней солей (табл. 21).
| Соль | Едва ощутимый вкус | Заметный вкус | Неприятный вкус |
| NaCl | 165 | 495 | 660 |
| MgCl2 | 135 | 400 | 535 |
| MgSO4 | 250 | 625 | 750 |
| NaNO3 | 70 | 205 | 345 |
В табл. 22 приведены различные стандарты питьевой воды: СССР, Международный (Всемирная организация здравоохранения), Европейский и США [29]. Важным критерием для определения пригодности воды для питья является минерализация. Согласно стандарту СССР, она не должна быть более 1 г/л. Однако не во всех случах удается обеспечить население водой такой невысокой минерализации. В некоторых районах пьют воду более минерализованную без какого-либо вреда для здоровья. Согласно О. А. Алекину, предельной нормой для засушливых районов можно считать следующие градации минерализации (в г/л):
Хорошая до 1,0
Удовлетворительная 1,0-2,0
Допустимая 2,0-2,5
Предел 2,5-3,0
Очень малая минерализация (до 100 мг/л) также ухудшает качество воды, а лишенная солей вода вообще считается вредной, так как она понижает осмотическое давление внутри клетки. Это как раз относится к Крайнему Северу и районам, использующим воду от таяния ледников, где очень низкая минерализация воды и недостаточность в ней кальция является общей гигиенической проблемой. Так, например, на Кольском полуострове, где жесткость питьевых вод не превышает 0,36 ммоль/л количества вещества эквивалента (Г), а по вкусу она приближается к дистиллированной, возникла реальная необходимость в обогащении ее минеральными солями с целью улучшения вкусовых и гигиенических качеств.
| Вещество | Стандарты питьевой воды | |||
| СССР ГОСТ | Международный, 1963 | Европейский, 1963 | США, 1962 | |
| Свинец | 0,1 | 0,05 | 0,1 | 0,05 |
| Мышьяк | 0,05 | 0,05 | 0,2 | 0,05 |
| Селен | 0,001 | 0,01 | 0,05 | 0,01 |
| Фтор | 0,7-1,5 | 1,0-1,5 | 1,5 | 0,7-1,7 |
| Нитраты | 45,0 | 45,0 | 50,0 | 45,0 |
| Медь | 1,0 | 1,5 | 3,0 | 1,0 |
| Цинк | 5,0 | 15 | 5,0 | 5,0 |
| Железо | 0,3 | 1,0 | 0,1 | 0,3 |
| Хлориды | 350 | 600 | 350 | 250 |
| Сульфаты | 500 | 400 | 250 | 250 |
К воде, предназначенной для водопоя животных, требования должны быть примерно такие же, хотя некоторые животные могут пить и более минерализованную воду: верблюды и овцы пьют воду с преобладанием ионов Na+ и Сl- и минерализацией до 9 г/л. Однако степень влияния такой минерализации на организм животных еще не изучена.
При оценке качества хозяйственно-питьевой воды существенное значение имеет жесткость, которая определяется содержанием в воде ионов кальция и магния. Для централизованного водоснабжения ГОСТом допускается вода с жесткостью не выше 7,0 ммоль/л количества вещества эквивалента (19,6°). Повышенная жесткость вызывает нежелательные явления при использовании воды. При кипячении выпадает осадок в виде карбоната кальция и магния. В жесткой воде плохо развариваются овощи, мясо, крупы, плохо заваривается чай. Жесткая вода требует повышенного расхода мыла.
В табл. 22 указаны нормы для микрокомпонентов. Обычно в подземных пресных водах их содержание не достигает приведенных в таблице цифр. Появление же указанных концентраций - результат загрязнения воды. Только в кислых водах содержание микрокомпонентов может намного превышать установленные стандарты. Активная реакция питьевых вод (рН) должна находиться в пределах 6,5-9,5. В случае необходимости использовать воду при наличии вредных веществ прибегают к очистке воды путем окисления, осаждения и адсорбции этих веществ. Для примера укажем, что восточная часть Берлина (ГДР) снабжается аллювиальными водами р. Шпрее. Качество воды хорошее, но в ней содержится 7 мг/л железа, от которого освобождаются путем аэрирования воды. Железо окисляется и выпадает в осадок.
Остановим внимание на двух микрокомпонентах, имеющих серьезное санитарно-гигиеническое значение - фторе и иоде.
Фтор попадает в организм человека главным образом с водой. Но в природных водах его обычно мало. Наиболее высокие концентрации в подземных водах-артезианских и грунтовых. Кариес зубов, связанный с недостаточностью фтора в воде, является одним из самых распространенных заболеваний населения земного шара. Однако избыток фтора в воде разрушает зубы, вызывая другое заболевание - флюороз. Оказалось, что фтор стимулирует многие физиологические процессы в организме. Особенно важно, что он принимает участие в обмене фосфора, необходимого не только для нормального роста и развития костной ткани, но и для процессов кроветворения. Какое же количество фтора можно считать оптимальным для человека? Подавляющее большинство гигиенистов называют цифры от 0,7 до 1,2 мг/л. Там, где население пользуется питьевой водой с таким содержанием фтора, заметно снижается заболевание кариесом. В настоящее время применяется метод фторирования питьевой воды. В СССР оно впервые введено в городе многолетней мерзлоты - Норильске.
Иод в таблицу стандартов питьевой воды не включен, так как теперь доказано, что иод питьевой воды занимает обычно ничтожное место в йодном балансе человека. Тяжелые общие нарушения в организме, получившие название эндемического зоба, обусловлены недостатком иода в пище. Ранее было распространено мнение, что зоб связан с дефицитом иода в водах горных рек, питающихся ледниками. В действительности это не так, поскольку суточная потребность человека в иоде во много раз превышает его поступление с питьевой водой, которая даже в "благополучных" районах содержит около 0,01 мг/л иода. Но низкие концентрации иода в водах являются признаком его низкого содержания в почвах и местных продуктах питания.
Концентрация иода в воде хорошо отражает его содержание в почве, она может быть использована для характеристики "йодного уровня" данной территории. Например, для Украины П. С. Савченко (1955) составил "йодную карту". Он установил, что эндемический зоб наиболее распространен в районах, грунтовые воды которых содержат менее 0,001 мг/л иода (Полесье, Карпаты), умеренное распространение зоба наблюдается в районах, где грунтовые воды содержат 0,002-0,003 мг/л и слабое - при содержании до 0,003-0,004 мг/л иода. В степных районах Украины йодный уровень достаточно высок (особенно в приморских областях - около 0,02 мг/л). В настоящее время возник повышенный интерес к изучению поведения нитратов в связи с тем, что они служат одним из показателей загрязнения вод и, кроме того, этот компонент обладает токсичностью. Согласно принятым у нас и за рубежом стандартам, содержание нитратов не должно превышать 45-50 мг/л, что в пересчете на азот составляет около 10 мг/л.
При оценке химического состава воды для питьевого водоснабжения имеет значение не только концентрация растворенных в ней отдельных компонентов, но и характер комбинаций анионов с катионами, т. е. солевой состав. Приведем некоторые сведения о значении хлоридов натрия в пищевом рационе человека. Содержание хлористого натрия в жидкостях и тканях тела преобладает над другими минеральными соединениями. В плазме крови содержится 0,85 % NaCl. Осмотическое давление плазмы крови, равное 7,6-8,1 атм, возникает в основном за счет растворенной в ней поваренной соли. Благодаря осмотическому давлению соль удерживает воду. При повышенном содержании соли в организме растет объем тканевой жидкости и плазмы крови. Оба эти фактора способствуют повышению артериального давления. Наоборот, усиленное выведение соли приводит к обеднению организма водой и к падению артериального давления. Избыточный прием соли с пищей вызывает перегрузку регуляторных механизмов, что способствует стойкому повышению артериального давления.
Приведем примеры. Жители Багамских островов пользуются водой с высокой концентрацией хлоридов натрия и широко применяют соль для консервирования пищевых продуктов. Более чем у половины из них в возрасте от 40 до 50 лет артериальное давление превышает 150 мм рт. ст.2; это свидетельствует о начальной стадии гипертонической болезни. В 1954 г. в одном из сельских районов Закарпатья обнаружена высокая заболеваемость гипертонической болезнью у членов некоторых семей. Определили содержание хлоридов натрия в воде колодцев, из которых берут воду эти семьи. Установлено, что содержание NaCl здесь в 10 раз превышало содержание его в других колодцах. Другие исследователи тоже полагают, что высокий уровень артериального давления у населения, как правило, объясняется потреблением чрезмерного количества NaCl. Следовательно, при оценке питьевой воды повышенной минерализации надо учитывать, какие соли в ней играют доминирующую роль. Физиологическое влияние сульфатных солей, очевидно, будет иным.
Намечается связь между жесткостью воды и смертностью от некоторых заболеваний сердечно-сосудистой системы. Предварительные результаты говорят о том, что существует определенная зависимость между поражением сердечно-сосудистой системы и концентрацией ионов кальция в питьевой воде. Причина этого полностью не выяснена, однако ученые считают, что чем мягче вода, тем чаще у людей встречается предрасположение к заболеванию сердечно-сосудистой системы. Низкие значения концентрации кальция свойственны водам содового типа.
Помимо показателей по химическому составу, важное значение для оценки питьевой воды имеют характеристики ее микробиологического состояния. Основную опасность для питьевой воды представляет попадание в нее со сточными водами фекальных отбросов. Для выяснения возможной связи исследуемой воды с фекально-бытовыми водами пользуются микробиологическими показателями. Для централизованного водоснабжения ГОСТом допускается коли-индекс (количество кишечных палочек в 1000 мл воды) не более 3, а коли-титр (наименьший объем воды в миллилитрах, содержащий одну кишечную палочку) не менее 300. При несоблюдении этих норм на водопроводных станциях вода подвергается обеззараживанию путем хлорирования, озонирования и другими способами.
Следует отметить особую роль подземных вод в питьевом водоснабжении. По сравнению с поверхностными они имеют значительные преимущества, так как в меньшей степени подвержены загрязнению и обладают более устойчивым химическим составом. Идеальным источником водоснабжения являются артезианские воды, перекрытые водонепроницаемыми пластами и этим защищенные от загрязнения. Они обычно отличаются высокой прозрачностью, почти полным отсутствием болезнетворных микроорганизмов. Там, где имеются достаточные запасы подземных вод, рациональнее всего использовать их для питьевого водоснабжения. Например, в ГДР водоснабжение на 75 % организовано за счет подземных вод.
Используемая в области производства вода имеет различное назначение. В пищевой и бродильной промышленности она является своего рода сырьем, непосредственно употребляемым в технологии производства того или иного продукта. Предъявляемые в этом случае требования к воде должны соответствовать специфике данного вида производства: в сахарном - необходимо, чтобы вода имела минимальную минерализацию, так как присутствие солей затрудняет варку сахара; в пивоваренном - требуется отсутствие в воде CaSO4, препятствующего брожению солода; в винокуренном - нежелательно присутствие CaCl2 и MgCl2 (т.е. вод типа III), которые задерживают развитие дрожжей.
Вода, используемая в системе охлаждения, должна иметь возможно низкую температуру, незначительную жесткость, не должна оказывать разрушающего действия на аппаратуру.
В воде, используемой в фотопромышленности, текстильной и бумажной промышленности, нормируется присутствие железа, марганца, кремниевой кислоты и, особенно радиоактивных веществ. Производство искусственного волокна требует минимальной жесткости (до 0,64 ммоль/л количества вещества эквивалентов) и малой окисляемости воды (менее 2 мг/л).
Наиболее высокие требования предъявляются к химическому составу воды, идущей для питания паровых котлов. В этом случае вредны почти все компоненты состава воды и в первую очередь жесткость.
По соответствующим эмпирическим формулам дается оценка воды с точки зрения вспенивания, накипеобразования и коррозии. Требования, предъявляемые к составу воды, питающей котел, зависят от конструкции последнего. В настоящее время только в самых примитивных котлах применяют воду с естественным составом. Обычно вода подвергается предварительной обработке с целью удаления компонентов, вредных для котлового процесса. Такая операция называется водоподготовкой.
В отличие от питьевых вод, при оценке качества технической воды прежде всего учитывается жесткость. Различают общую жесткость, равную сумме концентраций находящихся в воде катионов Са2+ и Mg2+, карбонатную жесткость, обусловленную присутствием в воде гидрокарбонатов кальция и магния. В старой литературе карбонатную жесткость иногда называли "временной", сейчас этот термин вышел из употребления. Некарбонатную жесткость, определяемую наличием в воде солей сильных кислот кальция и магния (хлоридов, сульфатов, нитратов и т. д.), иногда называли "постоянной", этот термин сейчас также не употребляется.
Жесткость воды, согласно введенному в настоящее время стандарту, выражается в миллимолях количества вещества эквивалента Са2+ и Mg2+, содержащихся в 1 л воды. Один ммоль/л жесткости соответствует 20,04 мгСа2+/л или 12,16 мгМg2+/л. Если в воде содержатся соли кальция и магния, то жесткость выражается суммой ммоль количества вещества эквивалентов Са2+ и Mg2+ в 1 л воды.
По жесткости воды классифицируются следующим образом (в ммоль/л количества вещества эквивалента):
Очень мягкие до 1,5
Мягкие 1,5-3,0
Средние 3,0-6,0
Жесткие 6,0-10,0
Очень жесткие более 10
Применение жестких вод оказывается весьма неэкономичным в целом ряде производств и процессов. Будучи слабым проводниником тепла, накипь сильно снижает теплопроводность котла и вызывает поэтому непроизводительный расход топлива. Слой накипи даже в 1 мм вызывает перерасход топлива до 5%. Под слоем накипи интенсивно протекают и коррозионные процессы. При известных условиях накипеобразователи не осаждаются в виде плотных осадков, а образуют подвижные смеси (шлам). Шлам нарушает правильную циркуляцию воды в котле.
Образование накипи - это сложный физико-химический процесс, сущность которого состоит в выделении твердой фазы из пересыщенных растворов. При непрерывном испарении воды концентрация растворенных солей в ней будет все время увеличиваться, и по достижении предела растворимости при данной температуре соли начнут выпадать в осадок. Обычно выпадают в осадок соли, отличающиеся малой растворимостью (СаСО3, MgCO3, CaSO4, CaSiO3, MgSiO3). Соли, обладающие высокой растворимостью (NaCl, MgCl, СаС12, MgSO4, Na2SO4 и др.), отложений не дают, так как предел их растворимости в котлах обычно не достигается.
Химический состав накипи зависит от того, какие преимущественно соли содержались в воде. При кипячении из воды может быть удален весь углекислый газ и тогда гидрокарбонаты кальция и магния переходят в труднорастворимый карбонат:
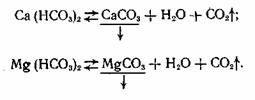
Физическая структура образующихся при этом твердых осадков может быть различной - от аморфного порошка до твердого кристаллического образования.
Если в воде содержался в значительном количестве сульфат кальция, то он образует гипсовую накипь. При содержании в воде кремнекислого натрия и других растворимых солей кремниевой кислоты в котле происходит взаимодействие между ними и сульфатами кальция и магния, в результате образуются труднорастворимые силикаты, например:
Силикаты кальция и магния образуют кремнекислую или силикатную накипь. Особенностью этих солей является то, что и без того их малая растворимость при повышении температуры еще более понижается. Поэтому в тепловых аппаратах они оседают на наиболее нагретых частях. Кремнекислая накипь наиболее опасна для паровых котлов, поскольку она обладает низкой теплопроводностью, вследствие чего может произойти перегрев и взрыв котла. Непригодную для питания паровых котлов воду подвергают умягчению. Под последним понимается процесс, приводящий к снижению жесткости воды, т. е. к уменьшению в воде концентраций солей кальция и магния. Существуют разные способы умягчения: термический, химический (содово-известковый), при помощи катионитов и др.
Природные воды обладают в той или иной степени свойством агрессивности по отношению к бетону, железобетону и металлам. Агрессивность вод чаще всего обусловлена присутствием ионов водорода (кислые воды), свободной углекислоты, сульфатов и магния. Согласно ГОСТу 4796-49, различают пять видов агрессивности.
Агрессивность выщелачивания определяется карбонатной жесткостью воды. В пластах, сложенных сильнопроницаемыми породами (крупнозернистый песок), сильнотрещиноватые породы и т. д.), вода считается агрессивной: для портландцемента с карбонатной жесткостью 2,14 ммоль/л количества вещества эквивалента (6°), для шлакового портландцемента 1,07 ммоль/л количества вещества эквивалента (3°), для пуццоланового и песчано-пуццоланового портландцемента 0,54 ммоль/л количества вещества эквивалента (1,5°).
Агрессивность общекислотная определяется по количеству водородных ионов (по величине рН). Для всех перечисленных цементов в пластах высокой водопроводимости вода считается агрессивной: а) при рН<7 и карбонатной жесткости <8,6 ммоль/л (<24°), б) при рН > 6,7 и карбонатной жесткости >8,6 ммоль/л (>24°). Для слабопроницаемых пластов вода считается агрессивной при рН < 5.
Агрессивность углекислая устанавливается по содержанию в воде свободной углекислоты. Вода для большинства цементов в пластах высокой водопроводимости считается агрессивной, если выражение а[Са2+] в будет больше содержания свободной углекислоты (а и в - коэффициенты, определяемые в зависимости от карбонатной жесткости и количества ионов Cl + SO4 по таблице, приведенной в ГОСТе 4796-49). Максимальное содержание агрессивной углекислоты при наиболее опасных условиях - 3 мг/л, при наименее опасных - 8,3 мг/л. Агрессивность воды для слабопроницаемых пластов не нормируется.
Агрессивность сульфатная устанавливается в зависимости от состава бетона по ГОСТу. В породах высокой водопроводимости для бетона на портландцементе вода считается агрессивной при содержании ионов (в мг/л):
| Сl | SO4 |
| 0-3000 | 250-500 |
| 3001-5000 | 501-1000 |
| >5000 | >1000 |
В породах слабой водопроводимости для бетона на портландцементе вода считается агрессивной при содержании иона SO4 > 1000 мг/л, для бетонов на пуццолановом, шлаковом и песчанопуццолановом портландцементах - при содержании иона SO4 > 4000 мг/л независимо от содержания иона Сl.
Агрессивность магнезиальная определяется по наличию в воде ионов Mg2+. Для портландцемента, находящегося в сильнопроницаемых породах, вода считается агрессивной при содержании иона Mg2+ > 5000 мг/л; для пуццоланового, песчано-пуццоланового и шлакового портландцементов в сильнопроницаемых породах - при содержании иона Mg2+, приведенных ниже (в мг/л):
| при SO4 | Mg2+ |
| 0-1000 | >5000 |
| 1001-2000 | 3001-5000 |
| 2001-3000 | 2001-3000 |
| 3001-4000 | 1000-2000 |
Для слабопроницаемых пород агрессивность воды не нормируется.
Скорость углекислой, сульфатной и иных агрессий зависит от того, насколько быстро к сооружению притекают новые порции агрессивной воды на смену воде, утратившей разрушительные свойства. При относительно быстром подтоке к инженерным сооружениям вредность действия воды увеличивается.
Серьезное практическое значение имеет полученный экспериментальным путем вывод Ф. Ф. Лаптева о том, что агрессивность вод усиливается при смешении двух даже неагрессивных вод. С явлениями повышения агрессивности вод приходится считаться при нарушениях режима подземных вод, обусловленных строительством крупных сооружений.
Несколько слов о механизме сульфатной агрессии. Она проявляется:
1) в виде кристаллизации в бетоне новых соединений, образование которых сопровождается увеличением объема, что влечет за собой ослабление бетона или даже разрушение его;
2) в виде процесса выщелачивания из бетона некоторых его составных частей, в той или иной мере растворимых в воде.
Еще в середине прошлого века было установлено, что всякое бетонное сооружение, подвергающееся действию морской воды, неизбежно должно разрушаться. Разрушение бетона вызывается присутствующим в морской воде сульфатом магния. Эта соль, проникая вместе с морской водой в толщу бетона, вступает в химическое взаимодействие с известью:
В результате находящаяся в бетоне известь постепенно переходит в более растворимый сульфат кальция. Растворимость гидроокиси магния равна 18,2 мг/л.
В порах бетона может происходить кристаллизация таких минералов, как гипс и эпсомит:
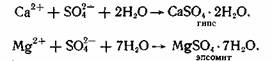
В первом случае процесс кристаллизации сопровождается увеличением объема приблизительно в два раза, во втором - в четыре.
Характеризуемое явление сильно выражено при колебаниях уровня грунтовых вод (переменное смачивание и высыхание), омывающих бетонные части сооружений, и в сухом климате.
Кроме того, находящийся в материале сооружений трехкаль-циевый алюминат ЗСаО-Аl2О3 вступает в реакцию с сульфатом кальция в растворе, при этом образуется сульфоалюминат кальция по уравнению
Реакция сопровождается сильным увеличением объема. За внешнее сходство с бактериями сульфоалюминат кальция иногда называют цементной бациллой. При образовании этого вещества в порах уже сложившейся структуры цементного камня возникают большие внутренние напряжения, способные нарушить целостность бетона. Если же образование сульфоалюмината или гипса протекает еще до формирования структуры бетона, опасных напряжений может не возникнуть. Разрушение не будет иметь места и в том случае, когда в водах, омывающих бетонное сооружение, содержится много хлоридов, которые повышают растворимость алюминатов и сульфоалюминатов.
При оценке пригодности воды для орошения, как и для питьевой воды, нельзя установить жестких норм, поскольку в каждом случае, помимо качества используемой воды, приходится учитывать особенности почв и гидрогеологические условия орошаемой территории. Благоприятный естественный дренаж, создающий отток вод с орошаемого массива, или глубокое залегание грунтовых вод исключает значительное накопление солей. Однако при неглубоком залегании грунтовых вод, плохо фильтрующих грунтах и отсутствии дренажа засоление будет протекать весьма интенсивно. В этом случае поливные воды еще больше повысят уровень грунтовых вод, усилят испаряемость и, следовательно, увеличат их минерализацию и засоление почв. Наибольшая опасность возникает при смыкании фильтрующихся сверху поливных вод с близко залегающими грунтовыми водами высокой минерализации.
Чтобы дать оценку пригодности воды для орошения, необходимо знать: 1) температуру, 2) минерализацию, 3) солевой состав и 4) ирригационный коэффициент.
Температура воды. Низкая температура является недостатком, так как задерживает рост растений. Для устранения этого недостатка воду перед орошением обычно собирают в особые бассейны-водохранилища, где вода постепенно нагревается под воздействием солнца и теплого воздуха.
Минерализация. Твердо установленных норм содержания солей для поливных вод до сих пор не выработано. В зависимости от условий полива и дренажа допускаемые значения минерализации воды могут варьировать в весьма широких пределах. Нормирование затрудняется и разнообразием почв, климатических условий, качественного состава и количества оросительной воды. С точки зрения минерализации безвредной, по А. Н. Костякову считается вода, содержащая не более 1-1,5 г/л растворенных солей. При содержании же солей от 1,5 до 3,0 г/л необходимо проведение на орошаемом массиве мелиоративных мероприятий. Предельной нормой допустимого общего содержания солей в воде А. Н. Костяков называет 5,0 г/л. Степень пригодности для орошения воды, обогащенной растворимыми солями, зависит от типа почвы, состава растворенных солей и вида выращиваемых растений. На легко проницаемых и хорошо дренированных почвах может применяться более минерализованная вода, при тяжелых почвах со слабым дренажом нормы содержания солей снижаются.
Минерализация воды наиболее крупных ирригационных систем Средней Азии и Закавказья (реки Сырдарья, Амударья, Зеравшан, Сох и др.) не превышает 1 г/л. Но отсутствие пресных вод вынуждает во многих случаях применять для орошения воды большей минерализации, как, например, воды рек Аракса (0,3-1,4 г/л), Шарибаддарьи (до 3 г/л), Атрека (1-9 г/л).
Солевой состав. Среди солей, растворенных в поливной воде, наиболее вредными считаются соли натрия. Степень вредности этих солей приблизительно характеризуется следующим соотношением масс: Na2CO3: NaCl: Na2SO4 = 1 : 3 : 10. Для хорошо водопроницаемых почв принимаются следующие предельные нормы содержания перечисленных солей (в г/л): Na2CO3-1,0, NaCl - 2,0; Na2SO4 - 5,0. При совместном присутствии этих солей в поливной воде нормы снижаются. Для улучшения качества воды с высоким содержанием соды добавляют гипс, который переводит Na2CO3 в менее вредный сульфат натрия.
Ирригационный коэффициент. Этот коэффициент был предложен Стеблером как критерий оценки качества ирригационной воды. Ирригационный коэффицент Ка вычисляется для каждого типа вод по следующим формулам:
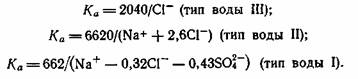
Значением данных коэффициентов определяется качество воды: Ка > 18 - хорошее; от 18 до 6 - удовлетворительное; от 5,9 до 1,2- неудовлетворительное и при Ка < 1,2 - плохое, т. е. вода является непригодной для орошения. К использованию Коэффициента ирригации следует относиться с осторожностью, так как известны случаи из мелиоративной практики, когда вода, согласно этому крите-рию, должна была считаться не пригодной для орошения, тем не менее применение ее для полива определенных культур позволило вырастить богатый урожай овощей на площади производственных масштабов.
Степень влияния химического состава воды на почвы зависит, помимо всего, от общих мелиоративных и агротехнических условий. Применение вод повышенной минера-лизации для полива сельскохозяйственных культур А. Н. Костяков считает возможным при следующих условиях:
1) на хорошо проницаемых почвах, не подстилаемых водоупорным слоем или безот-точными грунтовыми водами, где не происходит накопления солей;
2) если применять небольшие оросительные нормы, т. е. поливы делать малыми пор-циями, но более часто, чтобы не вводить в почву много солей и в то же время не создавать в верхних слоях почвы высокой концентрации почвенных растворов;
3) при хорошей агротехнике, позволяющей создавать и поддерживать комковатую структуру почвы и накапливать в почве атмосферную влагу;
4) если в данной местности после оросительного сезона выпадают осадки, достаточные для естественной промывки накопившихся в почве солей.
Изложенные способы оценки воды для орошения давно фигурируют в различных литературных источниках. Из-за недостатка пресных вод в настоящее время наблюдается тенденция к использованию для орошения посевов все более сильно минерализованных вод. Поэтому существующие критерии оценки уже не могут считаться удовлетворительными и рассматриваемый вопрос приобретает актуальное значение.
Многочисленными исследованиями доказано, что действительная концентрация почвенных растворов, как правило, значительно выше, чем концентрация солей в водах, обычно применяемых для орошения. Даже в самых лучших незасоленных орошаемых почвах Средней Азии и Закавказья концентрация солей в почвенном растворе составляет приблизительно 4-8 г/л. В среднезасоленных почвах концентрация почвенного раствора гораздо выше, она достигает 20-30 г/л. В сильнозасоленных почвах, включая солончаки, концентрация почвенного раствора в верхних горизонтах составляет 100-300 г/л.
Не только пресные, но и солоноватые (1-3 г/л) и соленые (3-10 г/л) оросительные воды вызывают резкое временное понижение минерализации почвенного раствора в верхних горизонтах почвы. Использование даже морских вод (35 г/л) для промывки солончаковых почв способно вызывать разбавление их почвенных растворов. Этим объясняются случаи успешного применения высокоминерализованных вод для орошения в пустынях.
После каждого полива разбавленный почвенный раствор, транспирируясь растениями и испаряясь, снова концентрируется. Если разведение достаточно велико и если соленые оросительные воды достаточно интенсивно удаляются с поля путем дренажа, относительно высокая минерализация оросительной воды может не приносить вреда. Согласно исследованиям В. А. Ковды, губительный для растений уровень концентрации почвенного раствора составляет около 12-15 г/л. Обычно растения, такие, как хлопок и люцерна, не могут существовать при более высокой концентрации растворов. Как полагает В. А. Ковда, любая оросительная вода, в которой концентрация солей ниже этого предела и составляет, например, 3-7 г/л, может быть успешно использована для улучшения и полива засоленных почв. Единственное важное условие заключается в том, что необходимо поддерживать преобладающее нисходящее движение почвенных вод, чтобы предотвратить сколько-нибудь значительное накопление растворимых солей в верхних слоях почвы.
При оценке пригодности соленой воды для орошения надо учитывать опасность засоления, в том числе хлоридного и борного, осолонцевания, карбонатного подщелачивания. В настоящее время невозможно предложить такую классификацию оросительных вод, которая могла бы быть использована в качестве практического руководства в любой местности и при любых условиях.
В СССР воды с минерализацией 200-500 мг/л считаются хорошими, а воды, ми-нерализация которых составляет 1-2 г/л, считаются опасными в отношении возможности засоления. Воды с минерализацией 3-7 г/л могут использоваться для орошения в виде исключения и только при наличии идеального дренажа и применения поливов промывного типа.