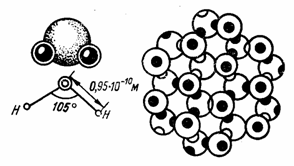
Рис. 1. Положение ядер водорода относительно атома кислорода в молекуле воды.
Вода - химическое соединение кислорода и водорода, которое принято обозначать формулой H2O. На самом деле вода имеет более сложный состав, и химическая природа ее до сих пор окончательно не установлена. Молекулярная масса воды равна 18, но встречаются молекулы с молекулярной массой 19, 20, 21 и 22. Они состоят из более тяжелых атомов водорода и кислорода, имеющих атомную массу соответственно более 1 и 16. У водорода два стабильных изотопа: протий (Н) и дейтерий (D); отношение Н : D составляет около 6700. Кроме того, известен еще один радиоактивный изотоп водорода с периодом полураспада 12,26 лет - это тритий (Т). У кислорода три стабильных изотопа: 16О (99,759%) 17О (0,037%) и 18О (0,204%). Имеются также более легкие радиоактивные изотопы, с периодом полураспада, исчисляемыми в секундах. Установлено, что изотопный состав кислорода атмосферного воздуха одинаков в различных пунктах земного шара.
Изотопная разновидность воды, в которой протий замещен дейтерием, называется тяжелой водой. Однако в природе до сих пор не открыта ни собственно легкая, ни тяжелая вода.
Тяжелую воду для технических целей в настоящее время готовят искусственно. Она отличается от обычной не только физическими свойствами, но и физиологическим воздействием на организм.
Особый геохимический и практический интерес представляет дейтерий (D). Электронная оболочка атома дейтерия, так же как и протия, состоит из одного электрона, но его ядро - дейтон - примерно вдвое тяжелее и состоит из двух частиц - протона и нейтрона. Дейтерий применяется в современной ядерной технике как взрывчатое вещество.
Различные по генезису природные воды имеют неодинаковый изотопный состав. Изотопный состав поверхностных вод континентов и атмосферы Земли зависит от ряда факторов и изменяется в широких пределах. Наиболее обедненная тяжелыми изотопами вода зафиксирована в осадках полярных регионов, а наиболее обогащенная - в закрытых бассейнах аридной зоны.
Одной из главных причин, создающих дифференциацию изотопов в природных водах, является процесс испарения. Упругость паров тяжелой воды несколько ниже упругости паров обычной, а так как процесс испарения является основным фактором круговорота воды, то обогащение вод тяжелыми изотопами в местах испарения и обеднение ими в местах конденсации может вызвать заметную разницу в плотности воды.
Установлена следующая закономерность распределения изотопов водорода в поверхностных и атмосферных водах:
- пресные поверхностные воды рек, озер и других водоемов, пополняющихся главным образом за счет атмосферных осадков, содержат дейтерия и кислорода-18 меньше, чем океанические воды;
- изотопный состав пресных поверхностных вод определяется физико-географическими условиями их нахождения.
Изучению внутреннего строения воды посвящены исследования фундаментального характера. По степени изученности некоторых свойств вода значительно превосходит другие вещества. Однако многие существенные особенности строения и свойства воды остаются еще невыясненными. Выявляются все новые свойства воды. Они не были известны раньше и не находят пока объяснения на основе прежних представлений о внутреннем ее строении.
Нас интересуют те особенности строения молекулы воды, которые придают ей интенсивную растворяющую способность и с которыми связаны специфические свойства, известные под названием аномалий воды. Еще в двадцатых годах нашего века на основе учения о полярной структуре молекул воды были разработаны простейшие представления об ассоциации молекул в жидкой воде как результат взаимодействия диполей. Эти представления заключаются в следующем. Одной из особенностей строения молекулы воды является несимметричное расположение атомов водорода вокруг атома кислорода: они расположены не по прямой, проведенной через центр атома кислорода, а под углом (рис. 1). Центры ядер атомов водорода расположены на расстоянии 9,5*10-8 см от центра атома кислорода. Угол между линиями, соединяющими центры атомов кислорода и водорода, равен 104,5°. Связь между атомами кислорода и водорода в молекуле воды осуществляется электронами. Вследствие несимметричности распределения электрических зарядов молекула воды обладает полярностью, т. е. имеет два полюса - положительный и отрицательный, которые так же, как и магнит, создают вокруг нее силовые поля.
Таким образом, для молекулы воды характерно дипольное строение (диполи). Их изображают в виде овалов, полюса которых имеют противоположные по знаку электрические заряды. При достаточном сближении молекулы воды начинают действовать друг на друга своими силовыми полями. При этом положительно заряженный полюс одной молекулы притягивает отрицательно заряженный другой. В результате могут получиться агрегаты из двух, трех и более молекул (рис. 2).

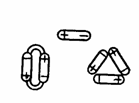
Такие группировки молекул воды называются дигидролями и тригидролями. Следовательно, в воде одновременно присутствуют одиночные (моногидроли), двойные и тройные молекулы. Содержание их меняется в зависимости от температуры. Во льду доминируют тройные молекулы, обладающие наибольшим объемом. При повышении температуры скорость движения молекул возрастает, и силы притяжения между молекулами оказываются недостаточными для удержания их друг около друга. В жидком состоянии вода представляет смесь дигидролей, тригидролей и моногидролей. С увеличением температуры тройные и двойные молекулы распадаются, при 100 °С вода состоит главным образом из моногидролей.
Хотя изложенные представления о строении воды были пересмотрены (рис. 3), основные выводы об известном соответствии структур, возникающих из связанных между собой молекул в жидкой воде и во льду, получили подтверждение и при последующих исследованиях. В дальнейшем разными исследователями на основе результатов, полученных с помощью экспериментальных методов, были разработаны различные теории жидкого состояния воды, но ни одна из них не находится еще в достаточном согласии со всей совокупностью экспериментальных данных о свойствах воды. Можно считать, что в жидкой воде находятся в динамическом равновесии образования из тетраэдрически связанных молекул и частично или полностью свободных молекул. Химически чистая вода обладает рядом аномальных свойств:
1) при нагревании воды от 0 до 4°С ее объем не увеличивается, а уменьшается, и максимальная плотность ее достигается не в точке замерзания (0°С), а при 4°С (точнее 3,98 °С);
2) вода при замерзании расширяется, а не сжимается, как все другие тела, плотность ее уменьшается;
3) температура замерзания воды с увеличением давления понижается, а не повышается, как этого следовало бы ожидать;
4) удельная теплоемкость воды чрезвычайно велика по сравнению с теплоемкостью других тел;
5) вследствие высокой диэлектрической постоянной вода обладает большей растворяющей и диссоциирующей способностью, чем другие жидкости;
6) вода обладает самым большим поверхностным натяжением из всех жидкостей, за исключением ртути;
Поверхностное натяжение и плотность определяют высоту, на которую может подняться жидкость в капиллярной системе при фильтрации через пористые среды.
Причина перечисленных аномальных свойств воды заключается в особенностях строения ее молекул.
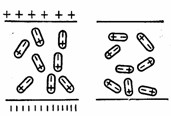
Если поместить воду во внешнее электрическое поле, то молекулы ее под действием поля стремятся расположиться в пространстве так, как показано на рис. 4. Это явление называется ориентационной поляризацией, ею обладают вещества с полярными молекулами. Высокая полярность молекул воды является одной из важнейших причин ее высокой активности при многих химических взаимодействиях. Она же служит причиной и электролитической диссоциации в воде солей, кислот и оснований. С нею связана также и растворимость электролитов в воде.
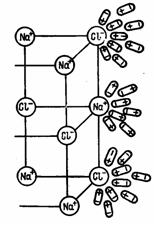
Растворение есть не только физический, но и химический процесс. Растворы образуются путем взаимодействия частиц растворенного вещества с частицами растворителя. Вода обладает способностью растворять многие вещества, т. е. давать с ними однородные физико-химические системы переменного состава (растворы). Растворенные в природных водах соли находятся в диссоциированном состоянии, в виде ионов. В твердом кристаллическом состоянии ионные соединения состоят из закономерно расположенных положительных и отрицательных ионов. Молекулы в этом случае отсутствуют. Так, например, в галите, как это определено рентгеновским структурным анализом, каждый ион Na+ окружен шестью ионами Сl-, а также ион Сl- шестью ионами натрия. Ионы взаимодействуют между собой, притягивая друг друга (ионная связь).
В чем состоит механизм растворения? Молекулы воды в силу особенностей своего строения и возникающего из-за этого вокруг них силового поля обладают способностью притягивать молекулы других веществ. Процесс растворения заключается как раз во взаимодействии частиц растворяющего вещества с частицами воды. При соприкосновении с водой какой-нибудь соли ионы, образующие ее кристаллическую решетку, будут притягиваться противоположно заряженными частицами молекул воды. Например, при погружении в воду кристаллов галита ион натрия (катион) будет притягиваться отрицательным полюсом молекулы воды, а ион хлора (анион) - положительным (рис. 5). Чтобы ионы кристаллической решетки оторвались друг от друга и перешли в раствор, необходимо преодолеть силу притяжения этой решетки. При растворении солей такой силой является притяжение ионов решетки молекулами воды, характеризуемое так называемой энергией гидратации.
Если при этом энергия гидратации будет по сравнению с энергией кристаллической решетки достаточно велика, ионы будут оторваны от последней и перейдут в раствор.
В зависимости от природы вещества при его растворении обычно происходит выделение или поглощение тепла. Ионы растворенного вещества притягивают и удерживают вокруг себя определенное число молекул воды, которые образуют оболочку, называемую гидратной. Таким образом, в водном растворе ионы являются гидратированными, т. е. химически связанными с молекулами воды (рис. 6). При кристаллизации многих солей часть гидратной воды захватывается кристаллическими решетками. Подобную кристаллизационную воду содержит гипс CaSO4*2H2O, мирабилит Na2S04*10H20, сода Na2CO3*10Н2О. Кристаллические вещества, содержащие молекулы воды, называются кристаллогидратами.
В воде могут растворяться твердые, жидкие и газообразные вещества. По растворимости в воде все вещества делятся на три группы: 1) хорошо растворимые, 2) плохо растворимые и 3) практически нерастворимые. Необходимо подчеркнуть, что абсолютно нерастворимых веществ нет. Так, стекло, серебро, золото - это примеры практически нерастворимых веществ. Однако и они в ничтожных количествах все же растворяются в воде.
Минерализацию (или сумму всех найденных при химическом анализе воды минеральных веществ) природных вод создают обычно ионы немногих солей: хлориды, сульфаты, гидрокарбонаты натрия, магния, кальция. Весьма важно иметь представление о растворимости этих солей, которая изменяется в значительных пределах (растворимость в промилле при 18 °С): СаСl2 - 732, MgCl2 - 558, NaCl - 359, MgSO4 - 354, Na2CO3 - 194, Na2SO4 - 168, CaSO4 - 2,01, MgCO3 - 0,022, СаСО3 - 0,013.
Как видим, растворимость многих солей очень высокая, за исключением сульфата и карбоната кальция. Однако при изучении природных вод относить CaSO4 к слаборастворимым солям никак нельзя. Эту соль все же следует считать сравнительно высоко растворимой и некоторые почвоведы, не без основания, называют гипс хорошо растворимой солью.
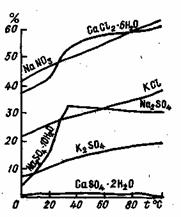
Растворимость твердых веществ в воде зависит не только от их химической природы, но и от температуры (рис. 7), давления, измельченности (дисперсности) и от наличия в воде газов и примесей.
Как видно из табл. 1, растворимость хлористого натрия мало изменяется при повышении температуры от 0 до 60 °С. Растворимость же карбоната и сульфата натрия сильно возрастает.
На растворимость кремнекислоты большое влияние оказывает температура. В системе кремниевая кислота - вода зависимость растворимости от температуры носит линейный характер. Температурный коэффициент равен 4 мг/(л*град), т. е. при 200°С растворимость кремниевой кислоты достигает 800 мг/л. В обычных условиях растворимость ее очень низкая (несколько миллиграммов в 1 л).
К числу солей, понижающих свою растворимость с ростом температуры, относится CaSO4. По мере возрастания давления растворимость в общем повышается, хотя и не намного. Поскольку в природных условиях давление меняется незначительно, влияние этого фактора на растворимость солей, за несколькими исключениями, сказывается слабо.
Как известно, растворимость данной соли уменьшается в присутствии другой соли, имеющей с ней одноименный ион, и, наоборот, повышается, если в растворе находятся неодноименные ионы. Например, пределы растворимости CaSO4 в присутствии различных солей сильно меняются. При наличии в растворе большого количества хлористого натрия (порядка 100 г/л) растворимость CaSO4 достигает 5-6 г/л.
Из главнейших солей минимальной растворимостью обладают карбонаты щелочных земель, но она увеличивается в несколько разнесли вода содержит двуокись углерода (СО2).
| Соль | Температура, °С | ||||||
| 0 | 10 | 20 | 30 | 40 | 50 | 60 | |
| NaCl | 35,6 | 35,7 | 35,8 | 36,1 | 36,4 | 36,7 | 37,1 |
| Na2CO3 | 7,0 | 12,5 | 21,5 | 40,8 | 50,0 | - | 46,6 |
| Na2SO4 | 5,0 | 9,0 | 19,2 | 41,0 | 48,0 | 46,8 | 45,3 |
Реакции эти носят обратимый характер и протекают до наступления определенного равновесия. В результате указанных реакций в воде появляются гидрокарбонаты кальция и магния. Следует отметить, что ни гидрокарбонаты кальция, ни гидрокарбонаты магния в твердом виде не существуют. Минерализация широко распространенных в природе гидрокарбонатных магниево-кальциевых вод обычно достигает 500-600 мг/л. В присутствии больших количеств СО2 растворимость Са(НСО3)2 и Mg(HCO3)2 может превосходить 1 г/л (углекислые минеральные воды).
С ростом температуры растворимость гидрокарбонатов кальция и магния в значительной степени уменьшается и при 100°С падает практически до 0. При высокой температуре эти соли разлагаются с выделением СО2 и выпадением карбонатов в осадок.
Отсюда следует, что гидрокарбонатные кальциевые и магниевые воды на глубинах, характеризующихся большими значениями температуры, существовать не могут.
Обогащение вод солями совершается не только путем простого растворения. Природные растворы образуются также при гидролитическом расщеплении некоторых минералов. К числу минералов, непосредственно нерастворимых в воде, но способных гидролитически расщепляться, относятся различные силикаты, алюмосиликаты, ферросиликаты и прочие, составляющие 75 % всех минералов земной коры. Под влиянием воды и углекислоты при выветривании силикаты и алюмосиликаты отдают в раствор основания Na+, K+, Ca2+, Mg2+. Указанные основания, соединяясь с СО2, образуют углекислые и двууглекислые соли или, при соответствующих условиях, сульфатные и хлоридные соли.
Все природные воды представляют газовые растворы. При изучении природных вод важное значение имеет следующее равновесие: природные воды - природные газы.
Обычно газ растворен в воде, но при избытке часть его может находиться в свободном (спонтанном) состоянии, т. е. в виде мельчайших пузырьков. Следовательно, всегда существует подвижное равновесие: растворенные в воде газы - свободные газы. Поглощение газа водой и выделение газа водой - важнейший физико-химический и физический процесс, сопровождаемый изменением ионно-солевого состава воды.
Газы находятся в водах в виде молекулярных растворов. Природные газы представляют собой, как правило, газовые смеси, в которых можно различать главные и второстепенные компоненты. Растворимость газов в воде зависит от природы газа, температуры, давления и минерализации воды. Большой растворимостью в воде обладают сероводород и углекислый газ.
Зависимость растворимости газов от давления определяется законом Генри: растворимость газов в данном объеме жидкости (при постоянной температуре) прямо пропорциональна давлению газа
Растворимость смеси газов определяется законом Генри - Дальтона: растворимость каждой составной части смеси газов в жидкости пропорциональна парциальному (частичному) давлению данной составной части над раствором.
Ввиду различной растворимости составляющих газовую смесь компонентов химический состав свободного и находящегося с ним в равновесии растворенного газа неодинаков. Возьмем для примера атмосферный воздух. В нем содержится азота 78%, кислорода 21 % и отношение кислорода к азоту приблизительно составляет 1:4. При парциальном давлении кислорода 0,21, а азота 0,78 растворимость газов при t=0°C будет равна (в °/оо по объему):
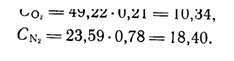
Газы H2S и H2, парциальное давление которых в атмосферною воздухе близко к нулю, в нормальных условиях не могут накапли ваться в воде у поверхности водоемов.
Больше всего растворяется газов в пресных холодных водах, тогда как с увеличением минерализации растворимость газа уменьшается. Содержание газов в природных водах определяется также интенсивностью химических, биологических и гидрологических (перемешивание, вертикальная зимняя циркуляция и др.) процессов. Поэтому содержание многих газов (O2, CO2, N2) часто выражают в процентах от их насыщающего количества. За насыщение принимают то количество газа, которое может растворяться в воде при данной температуре и минерализации (при сухом атмосферном воздухе и нормальном давлении).
Образовавшиеся при растворении солей ионные растворы обладают способностью проводить электрический ток, в то время как молекулярные растворы ток не проводят. Вещества, водные растворы которых проводят электрический ток, называются электролитами. Процесс распада электролитов на ионы под действием растворителя называется электролитической диссоциацией или ионизацией.
Сущность теории электролитической диссоциации сводится к следующим трем основным положениям:
а) все электролиты диссоциируют в растворах на положительно и отрицательно заряженные ионы;
б) под воздействием электрического тока положительно заряженные ионы движутся к катоду и поэтому называются катионами, а отрицательно заряженные - к аноду и называются анионами;
в) процесс диссоциации - процесс обратимый: параллельно с распадом молекул на ионы (диссоциацией) идет процесс соединения ионов в молекулы (моляризация).
Последнее обстоятельство заставляет в уравнениях электролитической диссоциации вместо знака равенства ставить знак обратимости. В растворах электролитов наряду с их ионами присутствуют молекулы.
В то время как скорость диссоциации по мере распада молекул уменьшается, скорость обратного процесса - моляризации - увеличивается. Когда скорости обоих процессов сравняются, наступит состояние равновесия, при котором относительное количество недиссоциированных молекул и ионов остается постоянным.
Отношение числа диссоциированных молекул к общему числу растворенных молекул называется степенью диссоциации электролита. Не все электролиты обнаруживают одинаковую способность к диссоциации. Одни из них полностью распадаются на ионы, другие частично и в разной мере. Сильные электролиты при растворении в воде полностью диссоциируют на ионы. К ним относятся многие соли, минеральные кислоты, основания щелочных и щелочноземельных металлов. Слабые электролиты при растворении в воде лишь частично диссоциируют на ионы. К ним относятся почти все органические кислоты, некоторые минеральные кислоты, например Н2СО3, H2S, H2SiO3, многие основания металлов. К слабым электролитам относится вода.
Кроме электролитов в растворе находятся и неэлектролиты, молекулы которых хотя и имеют гидратную оболочку, но настолько прочны, что не распадаются на ионы (02, N2). Поскольку все реакции в водных растворах электролитов представляют собой взаимодействие ионов, уравнения этих реакций следует писать в ионной форме. В качестве примера можно привести уравнение реакции взаимодействия растворов хлорида бария BaCl2 и сульфата натрия Na2S04. Молекулярное уравнение этой реакции записывается так:
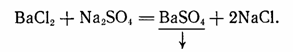
Полное ионное уравнение реакции, в котором хорошо диссоциирующие вещества записываются в виде ионов, а уходящие из сферы реакции вещества - в виде молекул, будет иметь вид:
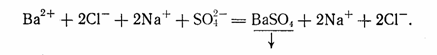
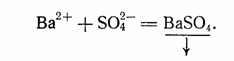
Несколько иначе записывается уравнение реакции между раствором хлорида калия КСl и раствором нитрата натрия NaNO3. Так как эти вещества и продукты реакции хорошо растворимы в воде и не уходят из сферы реакции, то уравнение данной обратимой реакции записывается в молекулярной форме так:
Если сократить в обеих частях этого уравнения одинаковые ионы, то можно прийти к тождеству 0 = 0. Это говорит о том, что с точки зрения теории электролитической диссоциации данная реакция не протекает. Однако если выпарить такой раствор, то ионы соединятся в молекулы и будет получена смесь четырех солей.
Реакции между ионами протекают в тех случаях, когда в результате их взаимодействия образуются малодиссоциированные, малорастворимые или газообразные вещества, иными словами, когда продукты взаимодействия уходят из сферы реакции. Многие вещества вступают с водой в реакцию обменного разложения, называемую гидролизом. При гидролизе имеет место сдвиг равновесия диссоциации воды Н2О - Н+ + ОН- за счет связывания одного из ее ионов ионами растворенного вещества с образованием малодиссоциированного или труднорастворимого продукта. Следовательно, гидролиз - это химическое взаимодействие ионов растворенной соли с водой, сопровождающееся изменением реакции среды. Ввиду обратимости гидролиза равновесие этого процесса зависит от всех тех факторов, которые вообще влияют на равновесие ионного обмена. В частности, оно сильно (иногда практически нацело) сдвигается в сторону разложения соли, если продукты последнего (чаще всего в виде основных солей) труднорастворимые.
Гидролизу подвержены соли слабых кислот и слабых оснований, слабых кислот и сильных оснований, сильных кислот и слабых оснований. Соли, образованные сильной кислотой и сильным основанием, гидролизу не подвергаются.
Если в какой-либо среде в виде очень мелких частиц распределено другое вещество, то такая система называется дисперсной. Свойства дисперсных систем, в первую очередь их устойчивость, сильно зависят от размеров распределенных частиц. Если раздробленное вещество доведено до размеров раздробления <1*10-6 м), такие высокодисперсные системы очень устойчивы, не разделяются при сколь угодно долгом стоянии.
К категории дисперсных систем относятся растворы. Всякий раствор состоит из растворенного вещества и растворителя. Часто бывает трудно установить, что является растворителем, а что - растворенным веществом. Условно принято считать растворителем то вещество, которое находится в избытке.
Однородность растворов и явления теплового эффекта при растворении приближает растворы к химическим соединениям. Возможность изменения концентрации растворенного вещества в широких пределах сближает растворы с механическими смесями. В зависимости от величины частиц растворенного вещества различают истинные и коллоидные растворы. Растворы называют истинными, когда растворенное вещество находится в них в ионизированном состоянии. В ионном растворе по принципу электронейтральности всегда содержатся равные количества эквивалентов катионов и анионов. В природных условиях ионные растворы образуются обычно при растворении простых солей.
Коллоидными называются такие растворы, в которых вещество находится не в ионизированном состоянии, а в виде групп молекул, так называемых "коллоидных частиц". Размеры частиц в коллоидных растворах лежат примерно в пределах 10-10 - 2*10-8 м. В устойчивых коллоидных растворах частицы в большинстве случаев несут электрические заряды, различные по величине, но одинаковые по знаку для всех частиц данной коллоидной системы. Коллоидные растворы называются золями. Золи способны переходить в гели, т. е. превращаться в студнеобразные массы в результате укрупнения коллоидных частиц (процесс коагуляции).
В природе коллоидные растворы могут быть органическими и неорганическими. Последние образуются преимущественно при гидролитическом расщеплении различных силикатов, которые при гидролизе выделяют заключающиеся в них основания (щелочные и щелочно-земельные металлы), дающие начало истинным растворам. Но, кроме того, при гидролизе в раствор переходят кремний, железо, алюминий и другие металлы, образующие большей частью коллоидные растворы.